Sécrétion des exosomes : au-delà de la simple fusion membranaire
L'article « Sécrétion des exosomes : au-delà de la simple fusion membranaire» a été publié sur le site internet de CNRS Biologie et a été partagé sur les comptes X/Twitter et Bluesky de CNRS Biologie.
Dans un article publié dans Journal of Extracellular Vesicles, des scientifiques montrent que la libération des exosomes, des vésicules extracellulaires qui permettent l’élimination des déchets cellulaires et la communication entre cellules, est plus complexe que ce que l’on pensait. Ils montrent l’implication de deux enzymes qui coupent des protéines participant à l’ancrage des exosomes à la membrane de la cellule. L’activité de ces enzymes étant finement modulée, cette découverte ouvre des perspectives nouvelles pour comprendre comment la libération des exosomes s’inscrit dans le fonctionnement normal et pathologique des cellules.
Les vésicules extracellulaires : fonctions et mécanismes de libération
Les vésicules extracellulaires (VE) sont des nanoparticules membranaires relarguées par la plupart des cellules. Elles participent à la constance du milieu intérieur en évacuant des déchets métaboliques et en jouant le rôle de vésicules de communication entre les cellules. Ce rôle homéostasique suppose l’existence de mécanismes précis contrôlant leur libération, mais ces mécanismes restent mal compris.
Les exosomes sont un sous-type de VE libérées par les cellules et produits à partir des endosomes. L’invagination de la membrane de l’endosome conduit à l’accumulation de petites vésicules intraluminales formant les corps multivésiculaires (MVB). Lorsque les MVB sont dirigés vers la membrane de la cellule, on pensait que la fusion de ce MVB avec la membrane plasmique suffisait à libérer les exosomes dans le milieu extracellulaire. Dans un article publié dans la revue Journal of Extracellular Vesicles, les scientifiques démontrent que cette dernière étape n’est pas suffisante pour libérer les exosomes. Utilisant différentes lignées cellulaires murines et humaines de nature épithéliale, neuronale ou immunitaire, ils mettent en évidence un mécanisme supplémentaire dans la libération de ces vésicules impliquant deux enzymes de la famille des ADAM (a disintegrin and metalloproteinase), ADAM10 et ADAM17. Ces enzymes sont des protéases, présentes à la membrane plasmique, qui assurent le détachement des vésicules intraluminales retenues à la surface des cellules. Elles coupent plusieurs protéines d’adhérence, dont CADM1 et la E-cadhérine, qui arriment la vésicule à la membrane plasmique, finalisant ainsi le relargage des exosomes.
Régulation de la sécrétion des exosomes et implications pathologiques
L’intensité de la sécrétion des exosomes, dépendante des ADAM, est régulée par deux voies de signalisation aux effets opposés sur la biodisponibilité et l’activité de ADAM10/17 à la membrane plasmique. Les kinases MAPK ERK1/2 stimulent la libération de ces VE, tandis que la kinase PDK1 (3-Phosphoinositide-Dependent Kinase-1) l’inhibe.
L’équilibre entre les voies ERK1/2 et PDK1 détermine donc le niveau basal de sécrétion des exosomes par la cellule.
Il reste à identifier, dans un contexte physiologique, les signaux et récepteurs capables de moduler ces voies pour ajuster la libération des VE. Sachant qu’une dérégulation de ERK1/2, PDK1 et ADAM10/17 a été associée à différentes maladies comme les cancers ou les maladies neurodégénératives amyloïdes, les scientifiques suspectent qu’une libération anormale des VE pourrait contribuer à la progression de ces pathologies.
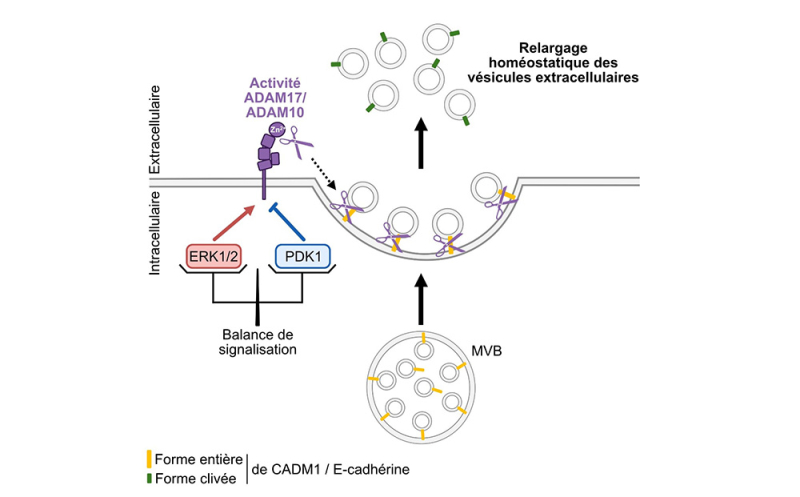
Figure : Implication des métalloprotéases ADAM10 et ADAM17 dans la libération contrôlée des vésicules extracellulaires.Dans les conditions physiologiques, l’intensité du relargage homéostatique des VE par les protéases ADAM10 et ADAM17 présentes à la surface des cellules dépend d’une balance de signalisation qui implique les kinases ERK1/2 et PDK1. ERK1/2 potentialise la libération des VE en induisant la phosphorylation des ADAM, ce qui augmente leur activité de clivage vis-à-vis des protéines d’adhérence CADM1 et E-cadhérine. À l’inverse, PDK1 s’oppose à la libération des VE en stimulant l’internalisation des ADAM, ce qui réduit la biodisponibilité membranaire des ADAM actives pour assurer le détachement des VE de la membrane plasmique.
En savoir plus : Bizingre C, Arellano-Anaya Z, Picard F, Pietri M, Baudry A, Roussel F, Bianchi C, Alleaume-Butaux A, Ardila-Osorio H, Romao M, Lavieu G, Raposo G, Schneider B. ADAM Sheddase Activity Promotes the Detachment of Small Extracellular Vesicles From the Plasma Membrane. J Extracell Vesicles. 2025 Jul;14(7):e70114. doi: 10.1002/jev2.70114. PMID: 40673783; PMCID: PMC12269338.


